尽管美国近年来通过生物安全法案加强对中国生物科技领域的打压,中国在这一高科技领域却依然展现出了强劲的发展势头和不屈的韧性。
尽管美国近年来通过生物安全法米乐M6 米乐平台案加强对中国生物科技领域的打压,中国在这一高科技领域却依然展现出了强劲的发展势头和不屈的韧性。尤其是在基因编辑技术的创新与应用上,中国的科研人员和生物科技公司正在攻克全球性难题,为人类的健康福祉做出重要贡献。即便在全球的生物科技竞争日益激烈的背景下,中国企业依然不畏艰难,勇敢前行,启动了治疗杜氏肌营养不良症(
DMD)的CRISPR基因编辑临床试验,这一突破不仅展示了中国企业在生物医药领域的创新能力,也证明了他们在国际舞台上日益增强的影响力。

CRISPR具有比现有DMD基因疗法更有效管理这种疾病的潜力,尤其是相对于顶着巨大争议上市的Sarepta的基因疗法Elevidys。后者尽管可能有一定疗效,但真正治愈DMD仍然遥不可及。这种巨大的未满足现状也使得CRISPR承担了人们巨大的期望。但在美国,基因编辑治疗的前景仍然晦暗不明。美国的Vertex公司原计划去年提交CRISPR药物的IND申请,但后来表示需要进行更多研究。礼来也在今年4月终止了关于DMD基因编辑的合作,而其他著名基因编辑公司如Prime Medicine和Editas Medicine尽管曾表示对DMD有兴趣,但最终将其从研发管线中移除。
相比之下,中国两家生物科技公司不仅已经开始为患者提供治疗,还计划在未来将研究扩展至美国市场。要实现这一目标,他们需要证明CRISPR技术可以将编辑系统有效输送到足够多的肌肉细胞中。此前,唯一接受CRISPR治疗DMD的患者是一名27岁的男子Terry Horgan。他于2022年10月在接受CRISPR疗法的8天后不幸去世,他的年龄和健康状况很可能是导致这一悲剧的重要因素。然而这一事件为整个领域蒙上了阴影,令人对CRISPR技术的安全性产生了担忧。
DMD是由抗肌萎缩蛋白(dystro米乐 登录入口phin)基因的突变引起的,抗肌萎缩蛋白在吸收肌肉收缩产生的冲击力方面起着关键作用。研究人员一直在探索如何尽可能地修复患者的突变基因。传统的基因疗法通过病毒载体输送基因片段,但抗肌萎缩蛋白的基因过于庞大,无法通过常用的腺相关病毒(AAV)载体进行传递。因此,科学家们在上世纪90年代设计了一种缩小版本的基因。然而,这种简化基因可能是Elevidys效果不尽如人意的原因之一。相比之下,CRISPR技术则有望直接修复患者的基因突变,恢复基因的正常功能。然而,CRISPR在修补DNA方面的能力有限,更多地被用于切割DNA。幸运的是,科学家发现了外显子跳跃(exon skipping)的技术,能够通过跳过相邻的外显子来纠正基因的阅读框,从而恢复部分抗肌萎缩蛋白的功能。
尽管Sarepta的外显子跳跃药物已经应用于RNA层面,但其疗效有限,且药物难以进入肌肉细胞,需要米乐 登录入口频繁注射。反观CRISPR技术,Vertex和其他公司在将CRISPR技术应用于DMD治疗方面进展缓慢。CRISPR系统通常依赖脂质纳米颗粒(LNP)输送,但其主要作用部位是肝脏,而非肌肉细胞。要使CRISPR有效进入肌肉,仍需要更长时间的研究。而当前唯一可行的方法是通过大剂量的AAV病毒传递CRISPR系统。然而,高剂量AAV病毒存在安全隐患,Terry Horgan的死亡以及其他患者的病例就是警示。
辉大基因试图通过使用一种更小、更高效的CRISPR酶来降低剂量,使其能够装入单个AAV载体中。辉大基因计划在为首例患者治疗后三个月内评估效果,并在安全性得到保证后继续为其他患者进行治疗。新芽基因则采用了碱基编辑器(base editor)的CRISPR形式,这种技术无需切割DNA,直接将一种碱基转变为另一种碱基,但这个过程需要使用两个AAV载体。
值得注意的是,这并非中国首次在CRISPR治疗领域走在前列。中国在基因治疗方面的影响力日益增加,此前也曾率先批准CRISPR在人类身上的临床试验。美国的科学家和患者群体正在密切关注这些试验的进展,而中国的患者及其家属也寄予了厚望。目前中国尚未批准任何针对DMD的基因治疗,因此这些CRISPR疗法为患者带来了新的希望。辉大基因和新芽基因的疗法分别针对约13%和更少的DMD患者。如果这些疗法成功,未来还需要开发更多的治疗方案来覆盖其他突变热点。

从3月份开始,在杭州的一家医院,20名年龄在6至19岁之间、患有系统性红斑狼疮(SLE,systemic lupus erythematosus)的患者接受了Precision Biotech Co.(重庆精准生物技术有限公司)开发的CAR-T治疗,以往的标准治疗未能改善这些患者的病情。
在杭州试验中,首位患者是一名12岁女孩,在接受精准生物的免疫治疗六个月后,已经不再出现狼疮症状。这种免疫疗法的过程是将具有抗病能力的T细胞在实验室中进行工程化和扩增,然后再重新注入患者体内以对抗疾病。自那以后,研究人员已对另外19名儿童患者完成了CAR-T治疗。所有患者都经历了不同程度的缓解,但随访期仍然较短,尚无法确定疗效是否会持续。
杭州的试验还展示了中国在这方面迅速赶上西方对手的进展。尽管中国拥有全球最多的CAR-T试验,但其疗法获得监管批准的数量仍然很少。虽然如此,中国公司传奇生物科技(Legend Biotech Corp.)的多发性骨髓瘤CAR-T治疗药物Carvykti已授权给强生,并获得FDA的批准。这已经让全球制药巨头们对中国企业充满信心,包括诺华与传奇的合作,以及阿斯利康收购中国细胞治疗开发公司Gracell Biotechnologies(亘喜生物科技)。
随着全球生物技术行业的发展,越来越多的中国企业开始与美国风险投资者合作,创建新型美国初创公司,以开发有前景的药物化合物。这种被称为NewCo模式的融资策略,不仅可以确保中国企业在疗法成功时获得可观回报,还能有效规避因地米乐M6 米乐平台缘政治紧张带来的市场风险。根据L.E.K. Consulting的分析,2024年已有至少五家由中国企业在美国建立的新初创公司(表1),反映出这一融资方式的逐渐普及。
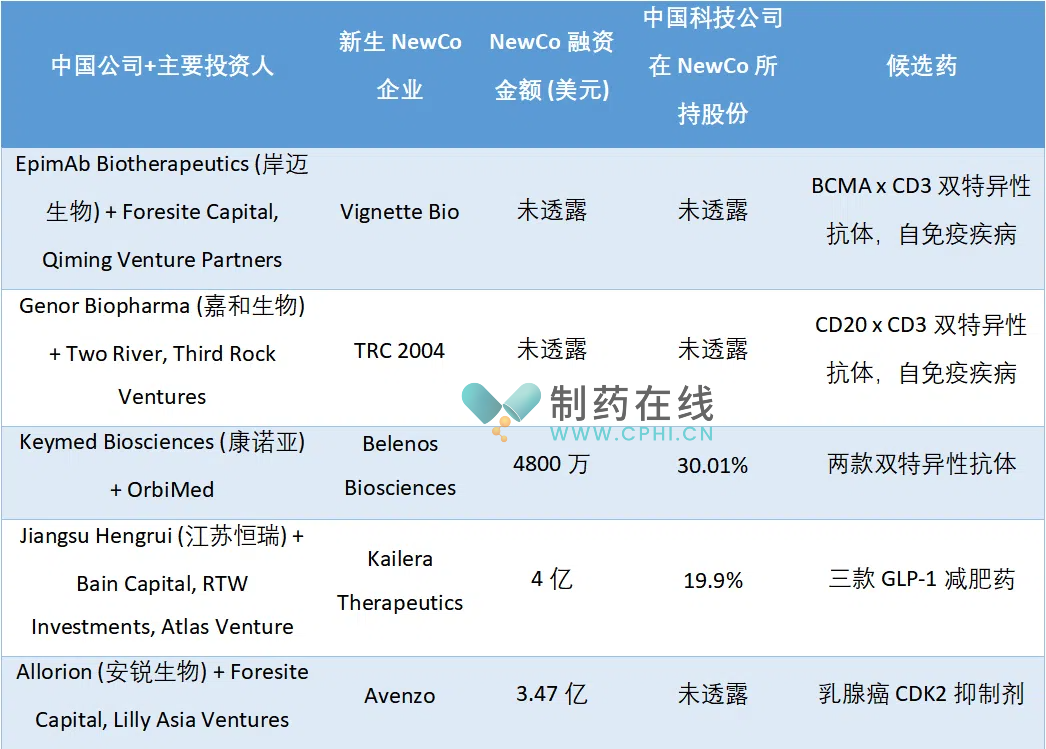
NewCo模式通常涉及中国生物公司与风险投资机构合作,共同出资创建新的企业。这为中国企业提供了一条替代融资的路径,避免了直接将资产许可给大型西方制药公司的限制,后者通常会削弱企业在药物开发中的参与度。在当前资金流动性紧张的环境下,中国生物技术公司仍在努力寻找新的融资渠道,尽管他们在哮喘、减肥等领域已取得了一定的突破。
江苏恒瑞医药在2023年将其哮喘药物的中国以外权利以2500万美元出售给新成立的Aiolos Bio,然而GSK随后以高达14亿美元的价格收购Aiolos,使恒瑞失去了进一步获利的机会。为了避免重蹈覆辙,恒瑞在今年与新公司Kailera Therapeutics合作时,确保保留了近20%的股份,并获得了1.1亿美元的预付款,Kailera则获得了来自Bain Capital和RTW Investments LP等的4亿美元融资。
对于海外投资者而言,NewCo模式提供了一种新的投资渠道,能够借助中国的科学成果,同时让中国公司利用西方合作伙伴的专业知识和网络,加快临床研究的进展及交易谈判。虽然NewCo模式在生物制药界并不新鲜,辉瑞和阿斯利康等公司通过初创企业获得了丰厚的回报,但在中国的NewCo交易表明,中国生物技术行业正逐步成熟,能够利用竞争优势进行有利谈判。
知名生命科学投资者如OrbiMed Advisors、Third Rock Ventures LLC、启明创投和Foresite Capital等均参与了此类交易。近期,两家新成立的、获得风险投资支持的公司迅速从中国企业获得药品许可并被Candid Therapeutics Inc.收购,后者在9月份完成了一轮3.7亿美元的融资,显示出投资者的需求正在增长。
NewCo模式为中国企业带来了新的机遇,但行业观察者的谨慎态度也表明,实际的成功和收益仍然依赖于企业在全球临床试验中生成的数据质量。这促使中国生物技术公司更加重视研发的质量,以满足国际市场的高标准。

